Dieses Sprichwort ist wahr. In ganz Europa steigt die Thromboserate und mit ihr die Lungenembolierate in den Wintermonaten deutlich an. Dafür verantwortlich sind mit höchster Wahrscheinlichkeit die viralen Infekte und die Tiefdruckgebiete. Aktuell trifft das auch auf die momentan herrschende Covid-19 Pandemie zu.
Die tiefe Venenthrombose ist eine äußerst heimtückische und dabei potentiell lebensgefährliche Erkrankung. 80 % der Thrombose Patienten bemerken das thrombotische Geschehen nicht. Das Erkennen einer tiefen Venenthrombose ist schwierig und erfordert viel Erfahrung in der Anwendung und Auswertung der diagnostischen Möglichkeiten. Die Symptomatik der Thrombose verhält sich wie ein Chamäleon. Von völliger Beschwerdefreiheit des Patienten (80%), über ein leichtes Ziehen oder Muskelkrämpfen bis hin zum Gefühl eines Muskelkaters, der nicht erklärlich ist, oder einem dumpfen Druck reichen die Empfindungen, die ein Patient angeben kann.
Besonders im Verlauf stationärer Krankenhausbehandlungen kann das erste Symptom der Thrombose eine Lungenembolie sein. Tragischerweise kommt es häufig vor, dass ein Patient an einem Tag noch symptomfrei im Bett liegt und am nächsten Tag aufgrund einer Lungenembolie plötzlich verstorben ist. Dieses “heimtückische” Geschehen macht diagnostische “Vorhersagemittel”, die schnell und unkompliziert angewendet werden können, für Ärzte und Patienten äußerst wertvoll.
Diese Vorsorgemittel sind Methoden und Fertigkeiten, die es dem Arzt ermöglichen Thrombose-Vorstufen zu erkennen, um dann im Vorfeld durch geeignete therapeutische Maßnahmen eine Thrombosebildung zu verhindern.
Ich sage meinen Patienten immer: Wer Beschwerden bemerkt, der hat schon einmal gewonnen. Nur mit wahrnehmbaren Beschwerden wird man gewarnt und kann einen Arzt aufsuchen, der nach der diagnostischen Abklärung eine Therapie einleitet.
Patienten, die schon einmal mit einem thrombotischen Geschehen konfrontiert wurden, sind eindeutig im Vorteil. Diese Patienten sind aus Erfahrung in der Lage, bei Symptomen daran zu denken, dass diese eventuell vom Venensystem ausgelöst werden und nicht muskulärer oder orthopädischer Herkunft sein müssen.
Umso wichtiger ist es, Thrombosen im Vorfeld ihrer Entstehung zu entdecken. Lesen Sie dazu unbedingt die Rubrik “Beinschmerzen” durch.
Ist das tiefe Venensystem gestaut und somit die Strömungsgeschwindigkeit herabgesetzt, liegt die grundlegende Prädisposition für eine Phlebothrombose vor. Der Körper reagiert auf die tiefe Venenstauung mit der Bildung eines Subfaszialen Ödems. Folglich ist das Subfasziale Ödem die einzige bekannte und fassbare Vorstufe der tiefen Venenthrombose. In der Regel schleicht es sich für die Patienten nahezu unbemerkt in die Beine ein. Erkennen, d.h. diagnostizieren ließ sich das subfasziale Ödem früher nur manuell durch eine subtile Palpationsmethode (6). Aber seit Februar 2019 ist es möglich, mit einer duplexsonografischen Untersuchungsmethode das Subfasziale Ödem sichtbar zu machen und zu dokumentieren. Wir haben diese Untersuchungstechnik den sonografischen Faszienlogen-Scan nach Holtzmann genannt (10).
Thrombose Diagnostik und Behandlung im Einzelnen
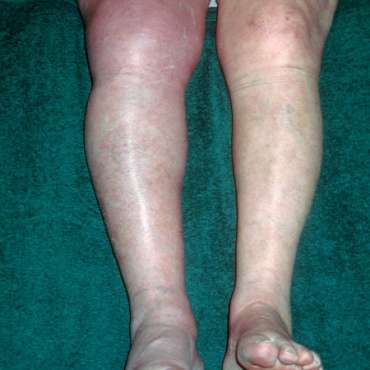
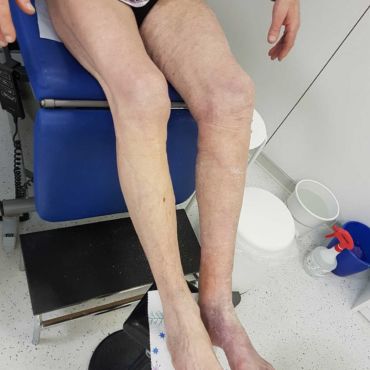
Auf Abbildung (a) sieht man die Beine eines 64-jährigen Patienten, der auf Grund eines außergewöhnlich starken Krampfes im rechten Bein in der Nacht zuvor in meine Praxis kam. Man sieht ein geschwollenes, leicht livide verfärbtes und durch die Hautspannung spiegelndes rechtes Bein. Hier liegt eine Unterschenkel-, eine Kniekehlen-, eine Oberschenkel- und Beckenvenenthrombose vor. Das Blut in allen tiefen Venen des rechten Beines sowie in der rechten Beckenvene ist geronnen. Wir nennen das eine Vier-Etagen-Venenthrombose. Abbildung (b):
So sieht die Thrombose im D-Dimer-Test (= Thrombose-Suchtest) aus. Im Testfeld erscheint bei “T” ein Streifen. “C” ist der Kontrollstreifen, der bei funktionierendem Test immer erscheinen muss. Dieser Test besagt, das > 500 μg/l D-Dimere im Blut vorhanden sind.
D-Dimer-Thrombose-Suchtest
Seit ca. 1995 gibt es einen chemischen Bluttest, mit dem man Fibrinspaltprodukte im Blut nachweisen kann. Bei einer tiefen Venenthrombose beginnt der Körper sofort den venösen Fibrin-Thrombus aufzulösen. Dabei entstehen Fibrinspaltprodukte, die D-Dimere genannt werden. Allerdings steigt der D-Dimer-Spiegel im Blut nicht nur bei der tiefen Venenthrombose an, sondern auch nach Verletzungen, bei Entzündungen, Infektionen, Hämatomen, physiologisch in der Schwangerschaft und im Alter (> 50. Lebensjahr). Für uns Phlebologen hat diese Tatsache die Konsequenz, dass ausschließlich ein negativer D-Dimer-Test aussagekräftig ist. Nur bei einem negativen D-Dimer-Test können wir mit 95%iger Sicherheit sagen, dass akut keine tiefe Beinvenenthrombose oder Lungenembolie vorliegt. Die letzten 5% Unsicherheit beziehen sich auf den Unterschenkel. Hier können sich trotz negativen D-Dimer-Tests Thrombosen verbergen. Folglich muss bei Beinschmerzen und negativem D-Dimer-Test eine farbkodierte Duplexsonographie zwingend zum Ausschluss einer Unterschenkelthrombose durchgeführt werden.
Den D-Dimer-Test gibt es als qualitativen Bedside-Schnelltest, der besonders für die ärztliche Schnelldiagnose geeignet ist. Dabei wird dem Patienten, wie bei der Blutzuckerbestimmung, ein Tropfen kapillares Vollblut aus einer Fingerbeere entnommen. Dieses Blut wird dann mit einem Tropfen Pufferlösung in die Probenöffnung der Testkassette gegeben. Ist die Konzentration der Fibrinspaltprodukte (D-Dimere) >500 Mikrogramm pro Liter, entsteht im Testlinien Bereich der Membran eine farbige Linie. Das Fehlen der farbigen Testlinie zeigt ein negatives Ergebnis an. Die Anwesenheit einer farbigen Bande im Kontrollbereich dient als Verfahrenskontrolle.
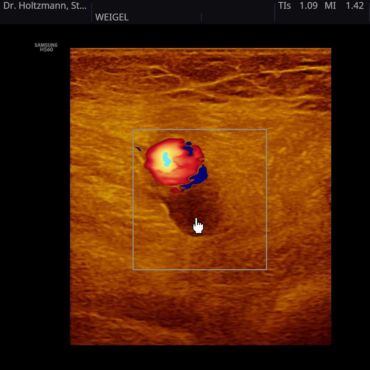
Abbildung c: Und so sieht die Thrombose in der Farb-Duplex-Sonografie aus. Wir sehen auf dem Bild die Kniekehle quer geschnitten. Oben pulsiert in der Schlagader das Arterienblut in das Bein hinein (rot kodiert). Darunter sieht man, aufgetrieben und ohne Strömungszeichen die Kniekehlenvene (Vena poplitea). Hier findet sich ein frisches Blutgerinnsel. Die Beschaffenheit eines solchen frischen venösen Thrombus darf man sich nicht wie Stein vorstellen, sondern eher wie sehr dickflüssige Marmelade oder flüssiger Teer.
Aber was ist so gefährlich an der tiefen Beinvenenthrombose?
Das Verstopfen der großen Abflusswege (Autobahnen) in den Beinen ist zwar für das Bein eine Zirkulationskatastrophe, aber dieses allein bedroht das Leben des Patienten nicht.
Jede Thrombose hat ein oberes Ende. Das ist der sogenannte Thrombosekopf. Solange das Gerinnsel frisch ist und noch nicht hart mit der Gefäßwand fest verklebt ist, können sich kleinere oder größere Teile vom Thrombosekopf lösen. Diese Teilchen, “Emboli” genannt, strömen mit dem Blutfluss entlang der tiefen Venen bis zum rechten Herzen. Vom rechten Herz geht es dann weiter in die Lungengefäße. Die Lungengefäße werden immer feiner und feiner, so dass je nach Größe der Embolus irgendwann einmal stecken bleibt.
Die Innenhaut der Lungengefäße ist jedoch mit Zellen versehen, die ein körpereigenes Heparin ausscheiden. Dieses körpereigene Heparin ist in der Lage, kleine Thrombosebröckel (Embolie) sehr schnell aufzulösen. Werden aber mehrere große Lungengefäßstämme verlegt wird der Strömungswiderstand für das rechte Herz mit einem Mal so groß, dass es nicht mehr weiterpumpen kann und stehen bleibt. Der Patient verstirbt innerhalb von Sekunden. Dies ist die plötzliche, tödliche Lungenembolie, die es bei der Therapie der Thrombose zu verhindern gilt.
Dr. Heinrich Fischer war der Erste, der erkannte, dass beim bisherigen Behandlungsschema der Thrombosen, nämlich strengste Bettruhe, zu viele tödliche Lungenembolien ausgelöst werden. Er sagte sich: Im Liegen entstehen die Thrombosen, mit Liegen werden sie behandelt, hier besteht ein Widerspruch!
Er entwickelte deswegen nicht nachgiebige und damit tiefenwirksame Verbände, legte sie seinen Patienten an und holte sie aus dem Krankenbett heraus. Zudem ließ er sie nach einem strengen Bewegungsschema drei- bis viermal am Tag schnell 30 Minuten gehen. Sein Erfolg war mit dieser Behandlungsmethode durchschlagend. 1910 veröffentlichte Heinrich Fischer nach ca. 3000 behandelten Venenentzündungen und Thrombosen seine Ergebnisse in der “Medizinischen Klinik” unter dem Titel: “Eine neue Therapie der Phlebitis” (4). Der große und berühmte Orthopäde Georg Hohmann, Freund Heinrich Fischers und Förderer seiner Methode, schrieb damals: Das Verfahren ist gut und wird mit der Zeit Allgemeingut der Ärzte werden.
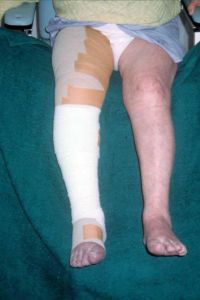
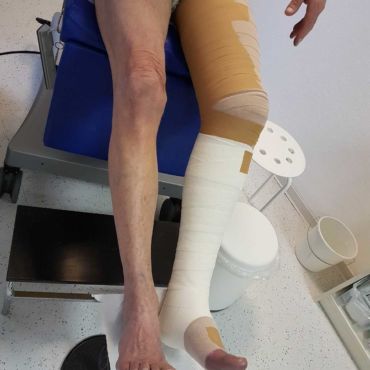
(re. Bein) im Fischer-Verband.
Es kam aber leider anders. Das Verfahren der ambulanten Thrombosetherapie geriet mehr und mehr in Vergessenheit. Eine Ausnahme bildeten die Schüler Heinrich Fischers, allen voran seine Söhne, Eduard Fischer (Wiesbaden) und Karl-Wilhelm Fischer (Stuttgart). Das Mutterhaus der Fischerverbände war dann für Jahrzehnte Stuttgart, wo die Tochter Karl-Wilhelm Fischers, Freya Haid-Fischer, die Fischerschule mit ihrem damaligen Ehemann Helmut Haid weiterführte.
Nach der Zulassung der niedermolekularen Heparine zur Thrombosetherapie (Frankreich 1987) änderte sich jedoch der Dornröschenschlaf der ambulanten Thrombosetherapie schlagartig. Dr. Hugo Partsch lernte die Fischermethode Anfang der 70er Jahre in Stuttgart kennen. 30 Jahre später, nachdem er Professor und Chefarzt der Universitätshautklinik in Wien geworden war, konnte er mit den Mitteln, die eine Universität bietet, die Vorteile der ambulanten Thrombosetherapie wissenschaftlich beweisen (13). Anfänglich reagierte die restliche Ärzteschaft aggressiv. Ich kann mich noch gut an den Kongress der Deutschen Gesellschaft für Phlebologie in Neu-Ulm (23.-25.09.1993) erinnern, als die Anwender der ambulanten Thrombosetherapie als Kriminelle beschimpft wurden. Jedoch der Paradigmenwechsel ließ sich nicht aufhalten. Schließlich etablierte sich die ambulante Thrombosetherapie weltweit als Standardtherapie.
Warum nicht nachgiebige Kompression?
Heinrich Fischer verwendete nicht nachgiebige Kompression in Form eines modifizierten Zinkleimverbandes nach Unna (Unna-boot) (17). Empirisch stand für ihn fest, dass nur hohe Kompressionsdrücke wirkungsvoll das tiefe Venensystem erreichen können. Diese Drücke dürfen nicht als Dauerdruck einwirken, sonst wären sie gewebeschädigend. Physikalisch ist eine Induktion intermittierender hoher Druckspitzen durch die Kombination nicht elastischer Kompressionsmaterialien mit therapeutischem Gehen möglich. Nach den Regeln der Physik müssen die von unelastischen Kompressionssystemen beim Gehen erzeugten Drücke für jeweils kurze Zeitspannen sehr hohe Amplituden erreichen.
Die hohen, kurzzeitigen (< 1/10 Sek.) Druckspitzen unter der nicht nachgiebigen Kompression beim Gehen lassen sich physikalisch erklären (9): Die allgemeine Definition von Druck: Druck ist ein Maß für den Widerstand, den Materie einer Verkleinerung ihres Raumes entgegensetzt. Oder einfacher: Drückt man etwas zusammen, drückt der Druck dagegen. Der Druck in einer Flüssigkeit (Gewebe) ist überall im Behältnis (unter nicht nachgiebigen Kompressionsverbänden) gleich und allseitig. Er steht immer senkrecht auf einem Hindernis (8).
Die hohe intermittierende Druckentwicklung unter nicht nachgiebigen Medien begründet sich über 2 besondere physiologisch/ biologische Effekte.
- Die Filament-Gleit-Schwellung (Phase 1 der Druckentwicklung). Die Filament-Gleit-Theorie erklärt die Abläufe bei der Kontraktion von Muskelfasern. Während einer Muskelkontraktion werden die Aktinfilamente in die Myosinfilament-Zwischenräume gezogen. Dadurch werden die einzelnen Sarkomere kürzer und dicker. Dies ist schön zu sehen auf einer mikroskopischen Vergleichsfotografie isolierter Myofibrillen im Anatomielehrbuch Benninghoff, Drenckhahn (2). Die Verdickung der einzelnen Filamente, Fibrillen, Fasern und Faszikel summiert sich zu einer kontraktionsbegleitenden Muskelbauch-Schwellung. Dieser Schwellungsvorgang tritt konstant und sofort bei jeder Muskelkontraktion auf. Er verschwindet vollständig in der Relaxationsphase.
- Der sogenannte Pumpeffekt/Muskelpump (spezifischer Begriff beim Bodybuilding-Sport) (Phase 2 der Druckentwicklung):
Die Muskulatur wird von bis zu 3000 Kapillaren pro mm2 Muskelquerschnitt durchzogen (14). 95% dieser Kapillaren sind im Ruhezustand geschlossen. Bei zunehmender körperlicher Aktivität werden diese 95% sukzessive geöffnet.
Mit weiter ansteigender Intensität der Muskelarbeit setzt die Stickstoffmonoxid-Synthese (NO-Synthese) ein. NO vergrößert den Radius der Arterien und reduziert dadurch den Strömungswiderstand. Die Muskeldurchblutung nimmt stark zu und kann etwa das 20-Fache (3) des Ruhewertes erreichen.
Die zunehmende Hyperämie lässt das Muskelvolumen um bis zu 20% anschwellen (8,5). Doch der Pumpeffekt soll nicht nur auf eine reine Hyperämie der Muskulatur zurückzuführen sein, sondern zusätzlich wird ein direktes Anschwellen der zellulären Strukturen diskutiert (15,16). Die intrazelluläre Verstoffwechselung der Kohlenhydrate produziert Milchsäure und diverse andere Stoffwechselprodukte, die ein Anschwellen der Zellen über osmotische Vorgänge induzieren. Der Pumpeffekt ist eine temporäre, von Intensität und Dauer der Muskelarbeit abhängige, verzögert einsetzende intra- und extrazelluläre vaskulär-metabolische Muskelschwellung (1,7). Im Bodybuilding-Sport entdeckt, wird der Pumpeffekt als direkte Wettkampfvorbereitung vor Wertungsauftritten genutzt.
Auch myosonografisch lassen sich diese beiden Schwellungstypen beobachten (12,15). Im kontrahierenden, erschöpfend belasteten Skelettmuskel schwillt die Querschnittsfläche je nach Muskel mit zunehmender Belastungszeit von 13 % bis über 50 % je nach Autor an (11, 12,15). Nach Belastungsende finden sich auch am wieder entspannten Muskel größere Muskeldurchmesser als vor der Belastung, die sich über einen durchschnittlichen Zeitraum von 7,5 Minuten zurückentwickeln (15). Bakke et al. berichtete 1996 (1), dass nach intensiver Belastung die Muskeldurchmesser erst nach 20 Minuten wieder auf das Ausgangsniveau zurückkehren. Bei sehr intensiver Belastung kann der Muskel sogar noch 5 Tage später verdickt sein (12).
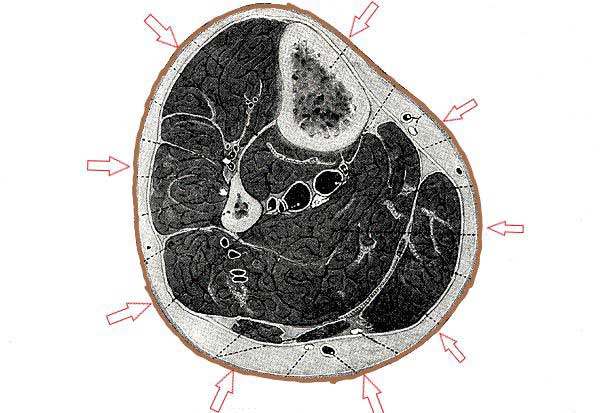
Die schematischen Unterschenkelquerschnitte (Abb. 8 und 9) veranschaulichen die Druckentstehung beim schnellen Gehen unter den unterschiedlichen Kompressionsmedien.
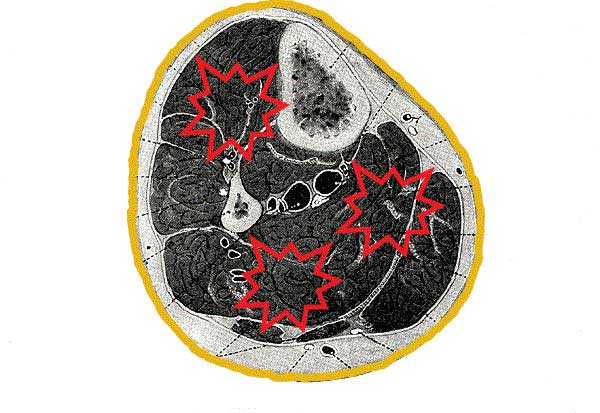
Abb. 8.: Die nicht elastischen Kompressionsmaterialien liegen wie ein Hydraulikschlauch über einem geschlossenen System. Sie minimieren einen Kraftverlust nach außen.
Bei einer maximalen Volumenzunahme von 13 % bis über 50 % je nach Autor (11,12,15) entwickelt die intermittierende Muskelschwellung (Filament-Gleit-Schwellung, die bei jeder Muskelkontraktion konstant auftritt und die verzögerte, belastungsabhängige Pumpeffekt-Schwellung) eine interne Kompressionskraft, die überall und allseitig unter dem nicht nachgiebigen Verband einen sehr kräftigen, aber kurzen Druckanstieg induziert.
Man kann das Geschehen mit einem Verbrennungsmotor vergleichen wobei der nicht nachgiebige Verband den Zylinder darstellt, in dem der Kolben (die Muskel-Schwellung) rhythmisch im Takt des Gehens das Gewebe verdichtet.
Nicht nachgiebige Systeme haben keine elastische Nachstellfunktion. Je ausgeprägter das Ödem, desto kürzer sollten die Verbandwechsel Intervalle sein.
Abb. 9: Hier ist zum Vergleich das Querschnittsbild eines Unterschenkels unter nachgiebiger Kompression dargestellt, bei der eine exogene Kraft die Hauptrolle spielt. Die textilelastische Kompressionskraft wirkt von außen auf das System ein und strebt dessen Verdichtung an. Die Schwellungskräfte der Muskulatur verpuffen größtenteils in der Elastizität des Strumpfes.
Zusammengefasst:
3 Kraftquellen sind an der Druckgenese bei der Kompressionstherapie beteiligt:
- der externe Anpressdruck des Kompressionsmediums,
- die interne Kraft aus der Filament-Gleit-Schwellung der kontrahierenden Muskulatur,
- die interne Kraft aus der zeitverzögert einsetzenden belastungsabhängigen vaskulär-metabolischen Pumpeffekt-Schwellung der Muskulatur. Sie ist verantwortlich für das spezifische Phänomen des biphasischen Druckanstiegs unter nicht nachgiebigen Kompressionsmedien.
Der Anpressdruck (Anlagedruck) des Kompressionsmediums wirkt bei der nachgiebigen und nicht nachgiebigen Kompressionstherapie gleichermaßen.
Die beiden internen Kraftquellen (Filament-Gleit-Schwellung und Pumpeffekt-Schwellung) summieren sich und entfalten nach Gehstrecken größer 800 m biphasisch eine Kraft, die je nach Steifheit des nicht nachgiebigen Materials im Binnenraum unter dem Verband (für < 1/10 sec.) vollständig in Druckkraft übergeht. Unter einer nachgiebigen Kompression verpufft diese Energie zum größten Teil in der Elastizität des textilen Materials. Beim schnellen und ausgedehnten Gehen entwickeln sich deshalb (biphasisch) signifikant höhere Druckamplituden als unter elastischer Kompression.
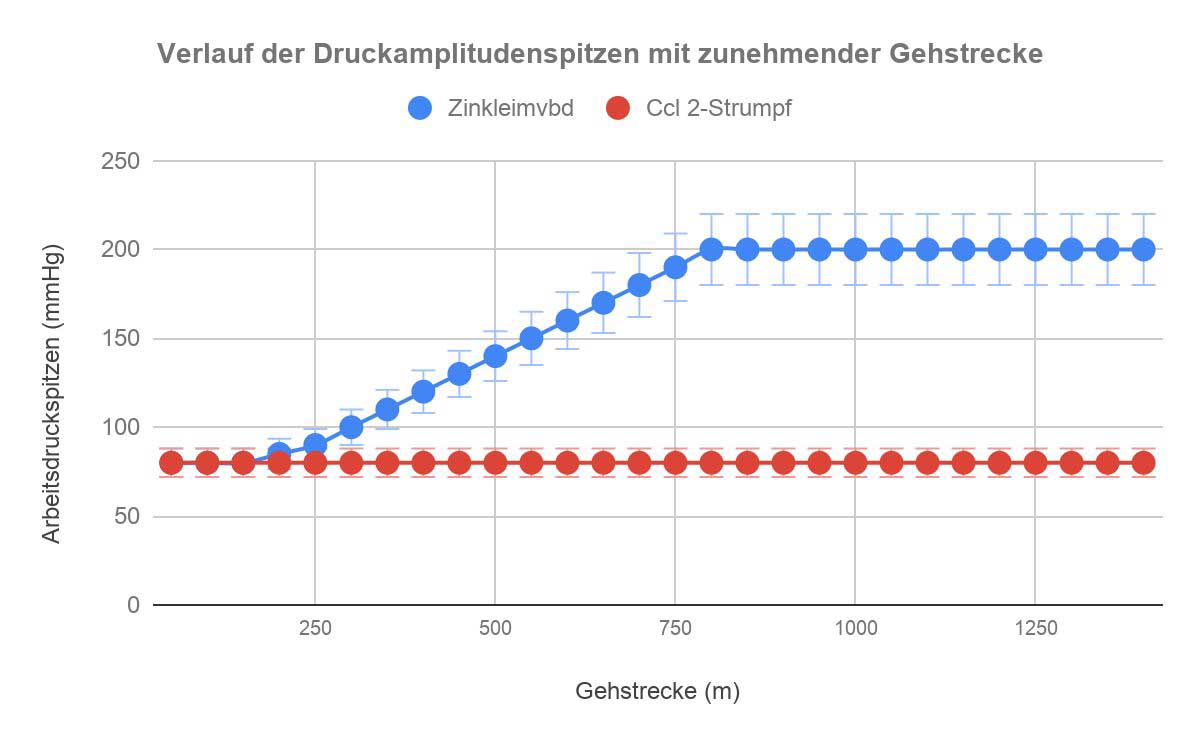
Die Grafik 1 zeigt die erreichten Arbeitsdruckspitzen (Mittelwerte) beim Gehen (∅ 5,5 km/h) einer Strecke von 1300 m. Biphasischer Druckanstieg unter dem Zinkleimverband. Phase 1 mit 80 mmHg Arbeitsdruckspitzen von 0 bis 300 m. Phase 2 ab 800 m mit 200 mmHg Amplitudenspitzen.
Als Resümee behält der alte phlebologische Leitsatz (2) weiterhin seine berechtigte Gültigkeit:

auch sofort die Fischerverbände angelegt.
Bis zum Knie einen nicht nachgiebigen Zinkleimverband, ab dem Knie aufwärts bis zur Leiste einen fixierten Klebeverband, welcher über dem Verlauf der tiefen Venen durch nicht nachgiebige Tapestreifen verstärkt ist. Der Patient muss 3-4 mal am Tag eine 1⁄2 Stunde schnell gehen. So kommt er in den einzigartigen Genuss des biphasischen Druckaufbaues unter Fischerverbänden.
Heutzutage antikoagulieren wir zusätzlich (Blutverdünnung) mit oralen Faktor-X-Hemmern in Tablettenform, z.B. mit Xarelto (Rivaroxaban).
Überraschend und eindrucksvoll ist, dass nach Anlage des Verbandes die Schmerzen sofort besser werden. Die Verbände werden zunächst täglich, dann in immer größeren Abständen gewechselt. Man kann so ganz exakt nach dem nachgebenden Schwellungsgrad des Beines immer eine passende Kompression anmodellieren. Die Dauer der Verbandtherapie beträgt ca. 4 Wochen. Dann gehen wir in der Regel auf einen Unterschenkel-Kompressionsstrumpf über.
Literatur:
- Bakke M et al., Ultrasonographic assessment of the swelling of the human masseter muscle after static and dynamic activity. Arch Oral Biol (1996), 41, 133–140.
- Benninghoff A, Drenckhahn D. Anatomie. Makroskopische Anatomie, Histologie, Embryologie, Zellbiologie. Elsevier, Urban & Fischer Verlag, München 2008. 17. Auflage. S. 159.
- Faller A, Schünke M. Körper des Menschen. Einführung in Bau und Funktion. Georg Thieme Verlag KG, Stuttgart, New York. 17. Auflage. S. 104.
- Fischer H. Eine neue Therapie der Phlebitis. Med. Klinik 1910;30. 1172–1173.
- Hach W, Gruß JD, Hach-Wunderle V et al. Venenchirurgie. Leitfaden für Gefäßchirurgen, Angiologen, Dermatologen und Phlebologen. Schattauer, Stuttgart. 2. Auflage. S. 330.
- Haid-Fischer F, Haid H. Venenerkrankungen. Phlebologie für Klinik und Praxis. Georg Thieme Verlag, Stuttgart New York 1985, S.149.
- Hamill J, Kuntzen KM, Derrick TR. Biomechanical Basis Of Human Movement. 4th Edition, Wolters Kluwer Health, Philadelphia, Baltimore, 2015.
- Harten U, Physik für Mediziner: Eine Einführung. 11. Aufl. Springer-Verlag, Berlin 2017. S. 54.
- Holtzmann M, Leben K. Spezifischer biphasischer Druckaufbau unter nicht nachgiebigen Kompressionsverbänden beim intensiven Gehen. Vasomed 2020;2:54–60.
- Holtzmann M, Leben K, Laxgang AN. Die Visualisierung und Objektivierung des Subfaszialen Ödems mit der Sonografie. Der sonografische Faszienlogen-Scan. vasomed (2020) angenommen.
- Kiliaridis S, Kälebo P, Masseter muscle thickness measured by ultrasonography and its relation to facial morphology. J Dent Res (1991), 70: 1262–1265.
- Murayama M et al. Changes in hardness of the human elbow flexor muscles after eccentric exercise. Eur J Appl Physiol (2000), 82, 361–367.
- Partsch H, Blättler W. Compression and working versus bed rest in the treatment of proximal deep venous thrombosis with low molecular weight heparin. J Vasc Surg 2000;32:861–869.
- Peterson L, Renström P. Verletzungen im Sport. 2. Aufl. Deutscher Ärzte-Verlag Köln, 1987:26–27.
- Reimers CD et al. Der Einfluß von Muskelarbeit auf das Myosonogramm. Ultraschall in Med (1995), 16:79–83. (15)
- Sj∅gaad G. Water and electrolyte fluxes during exercise and their relation to muscel fatigue. Act Physiol Scan Suppl 556:129–136,1986.
- Unna PG. Die Stauungsdermatosen des Unterschenkels und ihre Behandlung. Dtsch. Med. Zeitg. 5 (1885),1,13.