M. Holtzmann, K. Leben, A. N. Macario Perera Laxgang
Privatärztliche Ambulanz für Venenheilkunde, Stuttgart
Die Visualisierung und Objektivierung des Subfaszialen Ödems mit der
Sonografie.
Der sonografische Faszienlogen-Scan.
M. Holtzmann, K. Leben, A. N. Macario Perera Laxgang
Privatärztliche Ambulanz für Venenheilkunde, Stuttgart
Die Visualisierung und Objektivierung des Subfaszialen Ödems mit der
Sonografie.
Der sonografische Faszienlogen-Scan.
Zusammenfassung
Über das Subfasziale Ödem ist wenig bekannt. Bis vor 50-100 Jahren gehörte die palpatorische Detektion noch zum phlebologischen Standardrepertoir. Die sich entwickelnde bildgebende Diagnostik verdrängte diese manuellen Fertigkeiten nahezu vollständig. Schließlich ließ die fehlende Objektivierbarkeit das Subfasziale Ödem aus der Wissenschaft und den Lehrbüchern fast verschwinden.
Anfang 2019 entdeckten und entwickelten wir eine einfache, kostengünstige, reproduzierbare und dokumentierbare sonografische Methodik, um das Subfasziale Ödem eindeutig zu visualisieren und somit das Substrat wahrscheinlich aller phlebologischen Pathologien erstmals zu objektivieren. Der FL-Scan ist deshalb unser First-Line-Screening und Therapie-Monitoring Instrument (8). Zudem in letzter Konsequenz das erste Konzept einer definitiven Thrombose-Vorsorgeuntersuchung (Preventive checkup).
Wir stellen in dieser Arbeit die entwickelte diagnostische Methodik, den sonografischen Faszienlogen-Scan und einen semiquantitativen Score zur Graduierung des Subfaszialen Ödems vor.
Schlüsselwörter
Subfasziales Ödem, sonografischer Faszienlogen-Scan, Echostrukturveränderungen, Echogenitätserhöhung, venöse Hypertension, Proteoglykane, Schwellung im hinteren tiefen Kompartment.
Hintergrund
Alle Venenerkrankungen beruhen auf einer Störung des venösen Rückstroms (6). Beeinträchtigungen der venösen Rezirkulation lösen Stauungszustände aus, die wiederum prae- und subfasziale Ödeme (14) induzieren.
Von diesen zwei Ödem-Typen spielt das Subfasziale Ödem die gravierendere Rolle, da es das bedeutungsvollere tiefe Venensystem betrifft. Die Detektion dieses endofaszialen Schwellungszustandes ist aus therapeutischer Sicht von höchstem Interesse (14).
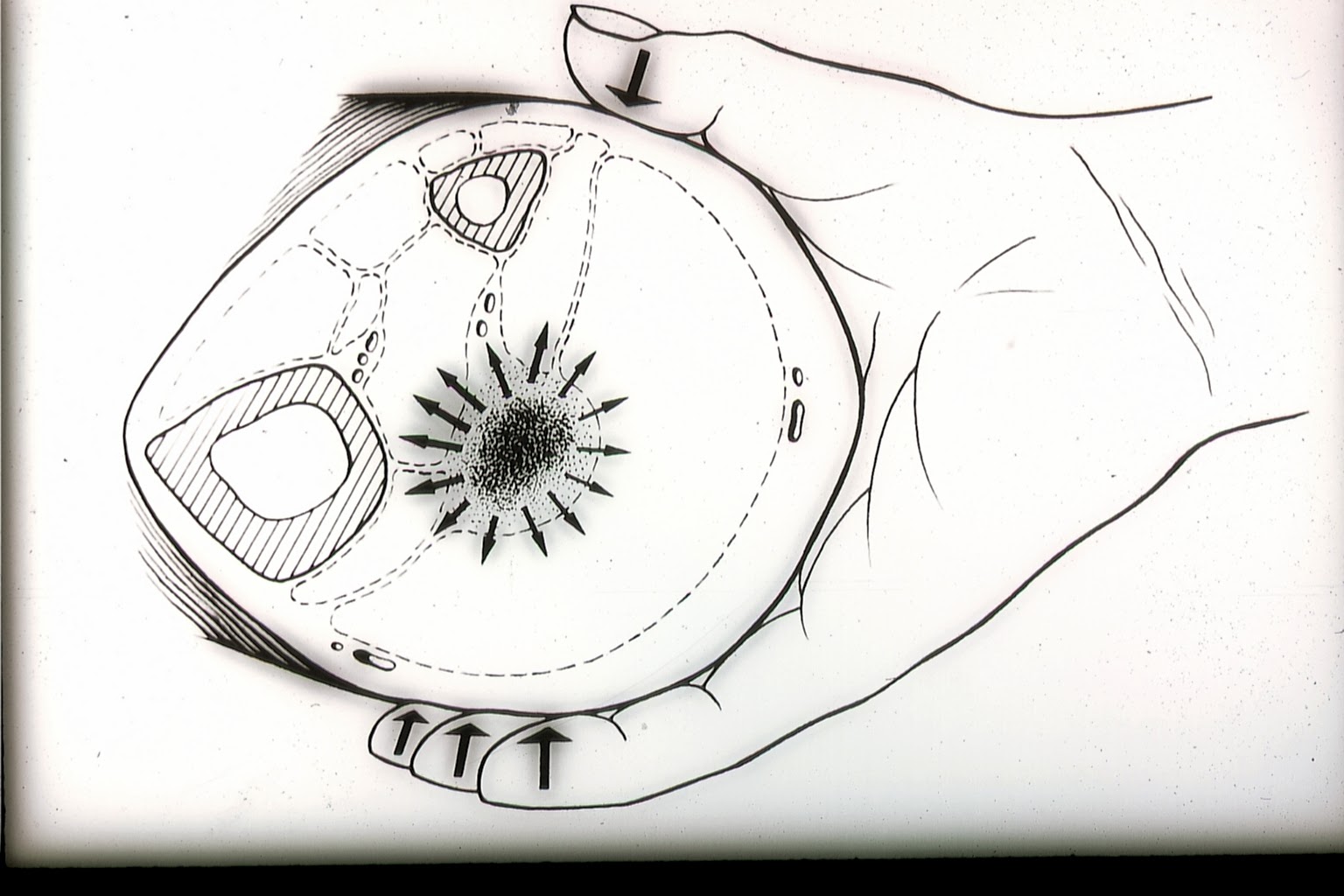
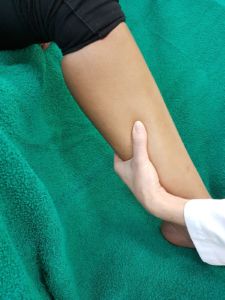
Unsere venenärztlichen Vorfahren waren mangels anderer Möglichkeiten zur Diagnostik des Subfaszialen Ödems auf ihren Tastsinn angewiesen (4). Das tiefe Venensystem selbst ist allerdings der tastenden Hand nicht zugänglich, aber die über vermehrte Außenfiltration (so dachte man bisher) infolge stauungsbedingter Venendrucksteigerung angespannte, die Gefäß-Nerven-Straße umgebende, Faszie. Bei der sogenannten “subtilen Palpation nach Fischer und Haid” trifft die tastende Hand auf das berührungsempfindliche Spannungsfeld der geschwollenen tiefen Flexorenloge (6). Der Patient bestätigt den Palpationsbefund durch Angabe eines kongruenten Druckschmerzes.
Abb. 1:
Die “subtile Palpation nach Fischer und Haid” ist eine klinische Untersuchungsmethode zur Detektion des Subfaszialen Ödems. Im positiven Fall tastet man den angestiegenen Turgor im hinteren tiefen Kompartment als eine charakteristische druckdolente Verhärtung.
(Haid-Fischer F., Haid H. Venenerkrankungen. Phlebologie für Klinik und Praxis. Georg Thieme Verlag, Stuttgart, New York. 1985.)
Abb. 2:
Stößt die palpierende Hand auf ein Subfasziales Ödem (die theoretische Vorstufe der Phlebothrombose), eröffnet sich die Chance einer frühzeitigen präventiven Therapie.
Man muss sich von der Vorstellung frei machen, dass es sich bei der Phlebitis nur um einen lokalen Befall der Vene handelt und bedenken, dass auch das umgebende Gewebe mit erkranken muss und die zirkulatorische Störung die ganze Extremität erfasst (6).
Die verschiedenen Palpations-Qualitäten sind Ausdruck des durch chronische venöse Stauung oder durch andere zirkulatorische Regulationsstörungen veränderten Gewebes. Die Palpation des perivaskulären Raumes hatte als Ziel, die einer akuten Phlebothrombose vorausgehenden oder nachfolgenden feingeweblichen Strukturveränderungen sowohl der Venenwand als auch ihrer Umgebung zu detektieren (6).
Allerdings ist über das palpable Substrat wenig bekannt. Die frühen Pathologen Olow (1930) (11), Rössle (1937) (17), Voegt (1937) (19), Neumann (1937,1938) (10) und Brass (1941,1949) (2) suchten mit mikroskopischen und histopathologischen Methoden nach feingeweblichen Strukturveränderungen, die einer Thrombose vorausgehen oder folgen. Sie beschrieben unspezifische stauungsbedingte vasale und perivasale Gewebereaktionen sowie zirkulationsbedingte Veränderungen in den zugehörigen Muskelpartien. Besonders Rössle (1937) fand bei Venenthrombosen in den Waden überraschend häufig Veränderungen der benachbarten Muskelfasern. Er war sich sicher, dass Venenstauungen zu Muskelveränderungen führen (16). Sein Schüler Voegt fand bei Kranken mit längerer Bettruhe gleichartige mikroskopische Veränderungen an den Wadenmuskeln (18).
Das Dilemma der manuellen Diagnostik ist die notwendige lange Erfahrung des Untersuchers, gepaart mit wohl einer gewissen Anlage und Liebe zum feinfühligen Tasten (6). Es ist daher verständlich, dass der Tastbefund mangels Objektivierungsmöglichkeit nicht ohne Weiteres anerkannt wird.
Der geübte und erfahrene Diagnostiker war allerdings in der Lage in der Tiefe des Gewebes mit den Fingerkuppen “zu sehen” und feinste Gewebeunterschiede zu differenzieren (6).
In dieser Veröffentlichung können wir zeigen, dass die durch venöse Stauung induzierte, druckdolent tastbare Logen-Turgorerhöhung im hinteren tiefen Kompartment des Unterschenkels, das Subfasziale Ödem, (myo)sonografisch als charakteristische Echostrukturveränderung sichtbar ist. Die hier publizierte Untersuchungsmethode haben wir den sonografischen Faszienlogen-Scan genannt. Damit lässt sich das Subfasziale Ödem erstmals visualisieren, objektivieren und graduieren.
Material und Methoden
Es wurden folgende Ultraschallgeräte verwendet:
GE Logiq S8, GE Logiq S7 Expert, GE Logiq S7 Pro, Samsung HS 60
Empfohlene Geräteeinstellungen:
Eine standardisierte konstante Einstellung des Sonografiegerätes sowie eine standardisierte Führung des Schallkopfs sind beim Faszienlogen-Scan zur Gewinnung valider Resultate unabdingbare Voraussetzung.
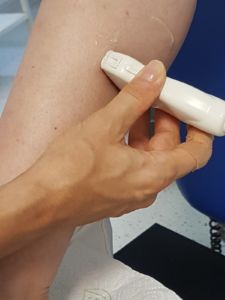
- Die Untersuchung sollte mit einem Linearschallkopf vorgenommen werden (14). Dieser bietet den Vorteil einer Geometrie getreuen Abbildung.
- Der Multifrequenz-Linearschallkopf bei den GE Geräten (9L) wird mit einer Center-Frequenz von 8,5 Megahertz eingestellt.
- Der Linearschallkopf LA2-9A des Samsung HS 60 wird mit der Center-Frequenz von 9 Megahertz ”Resolution” eingestellt.
- Es sollte ein hoher dynamischer Bereich gewählt werden (96 dB Dynamikbereich bei GE, 120 Dynamic Range bei Samsung), um viele Graustufen zu ermöglichen.
- Sendeleistung reduzieren, Empfehlung auf 60 %.
- Die tiefenabhängige Verstärkung (TGC) gleichmäßig einstellen.
- Kolorierung ist ratsam, um die Unterscheidung von Graustufen zu erleichtern.
- Streng senkrechtes Aufsetzen des Schallkopfes. Eine nicht exakt senkrechte Beschallung verändert die Darstellung der Muskelstruktur. Schon geringe Winkelschwankungen ziehen starke Änderungen der Echogenität nach sich. Analog der Technik bei der Myosonografie (1,3,5,7).
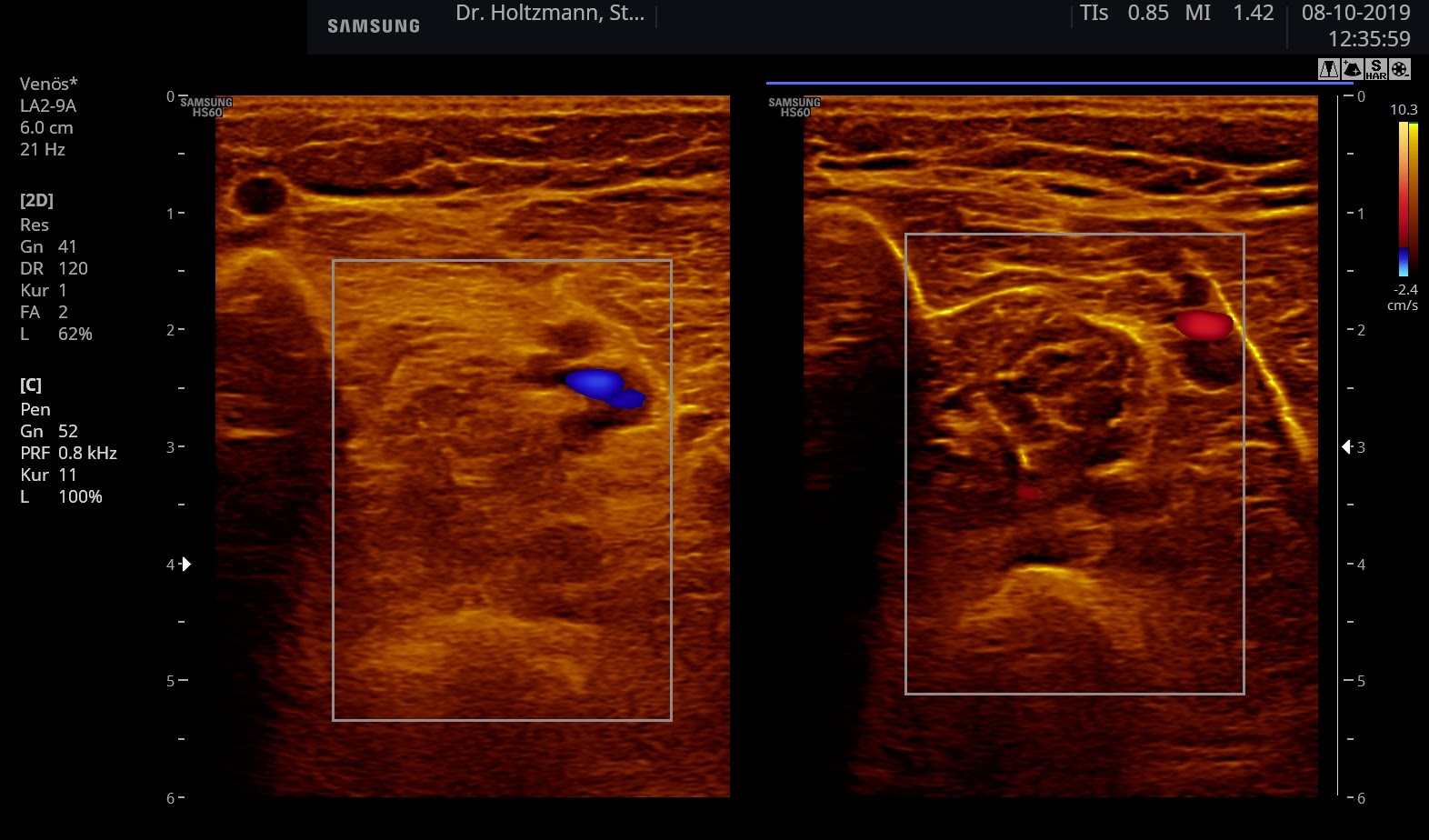
- Eingeschalteter Farbdoppler-Mode. Mit der Größe und Position des Farbfensters wird die Region of Interest (ROI) markiert.
- Splitscreen-Modus (Re-/Li-Modus, Dual-Modus) zum direkten Seitenvergleich. Beide Unterschenkel Transversalschnitte werden so gegenübergestellt, wobei die nicht oder weniger betroffene Extremität als Referenz dient.
Schallkopfführung und Positionierung:
- Sitzender Patient. Die Patientenmuskulatur ist entspannt. Anspannung des Muskels erhöht den Muskeldurchmesser und reduziert die Echogenität.
- Die Schallkopfnase zeigt nach ventral.
- Standard-Schnittebene ist der Transversalschnitt durch die tiefe Flexorenloge etwa am Übergang des medialen Gastrocnemius in die Achillessehne.
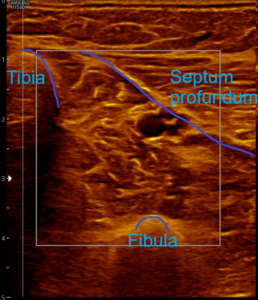
- Schallkopf so positionieren, dass die Bildbegrenzung links durch die Tibia, rechts durch die Lamina profunda (Septum profundum) bzw. die obere Flexorenloge und die Tiefenbegrenzung durch die Fibula erfolgt.
- Exakt orthograder Beschallungswinkel! Schallkopf ohne Druck aufsetzen (zur Vermeidung von Artefakten) (1,3,5,7).
- Die Untersuchung sollte immer bilateral als systematischer Seitenvergleich erfolgen, da der individuelle Aspekt entscheidend ist. Aus der Myosonografie wissen wir, dass die muskulären Echointensitäten interindividuell und intraindividuell von Muskel zu Muskel erheblich schwanken. Sogar innerhalb eines einzelnen Muskels können die Echointensitäten in den verschiedenen Bäuchen unterschiedlich sein (15).
Ergebnisse
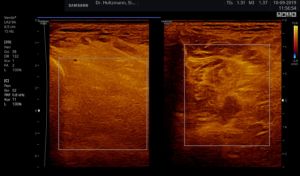
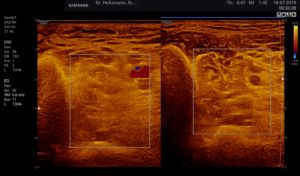
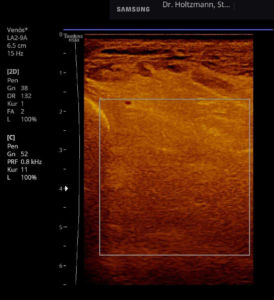
Ohne Palpationsbefund stellt sich die gesunde Muskulatur im hinteren tiefen Kompartment fast echofrei oder mit niedriger bis mittlerer Echogenität im Rechts-/Links-Modus gegenübergestellt dar (siehe Abb. 5). Fibroadipöse Septen und Perimysien sind echoreich sichtbar. Die Muskeln werden von reflexreichen Epimysien umgeben, die allerdings im hinteren tiefen Kompartment selten abgrenzbar sind, da ein Teil der reflektierten Schallwellen Anschallwinkel bedingt den Schallkopf verfehlt und damit für die Bildgenerierung nicht mehr zur Verfügung steht. Im Muskelquerschnitt kann sich das Sternenhimmelphänomen (reflexreiche, leuchtende Epimysien, Perimysien und Gefäßbindegewebe in “dunkler” Echostruktur der Muskulatur) zeigen (3,5,12,15,20,21).
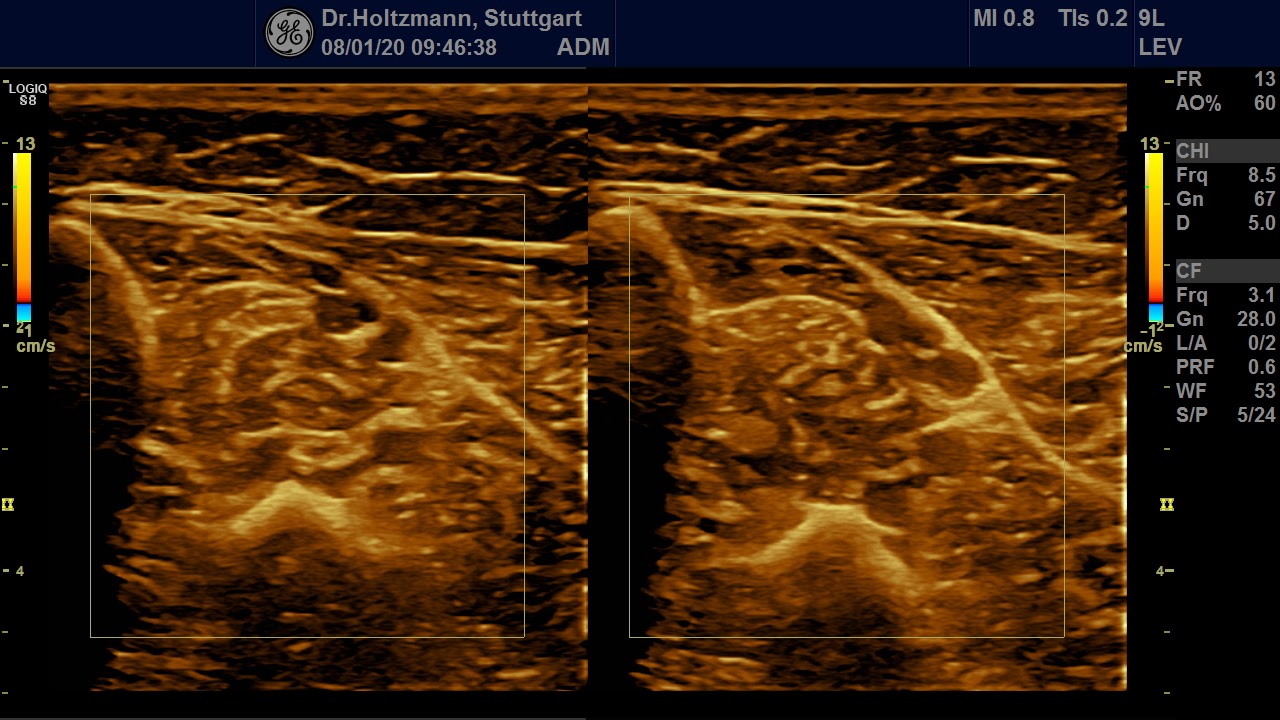
Abb. 5: Linker und rechter Transversalschnitt durch die tiefe Flexorenloge im Splitscreen gegenübergestellt. Beidseits normale Echostruktur bei negativem Tastbefund. Ausschluss eines Subfaszialen Ödems.
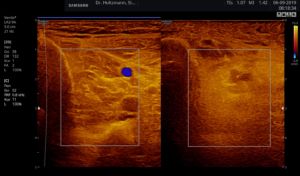
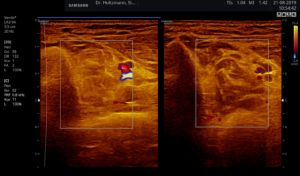
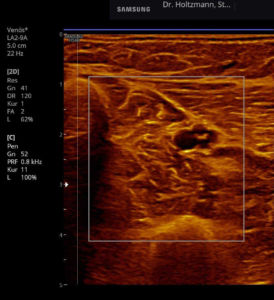
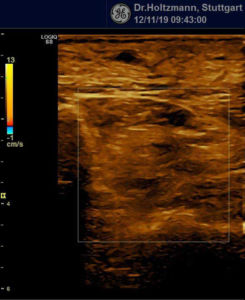
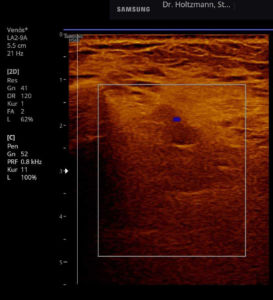
Ertastet man mit der subtilen Palpation nach Fischer und Haid (6) im hinteren tiefen Kompartment des Unterschenkels eine druckdolente Schwellung, das Subfasziale Ödem, so kann man regelmäßig die folgend gezeigten charakteristischen sonografischen Echostrukturveränderungen erkennen. Dabei ist die Beibehaltung der oben beschriebenen konstanten sonografischen Grundeinstellungen entscheidend. Die sonografischen Echostrukturveränderungen korrelieren in ihrer Ausprägung mit der Intensität des Tastbefundes und lassen sich so graduieren.
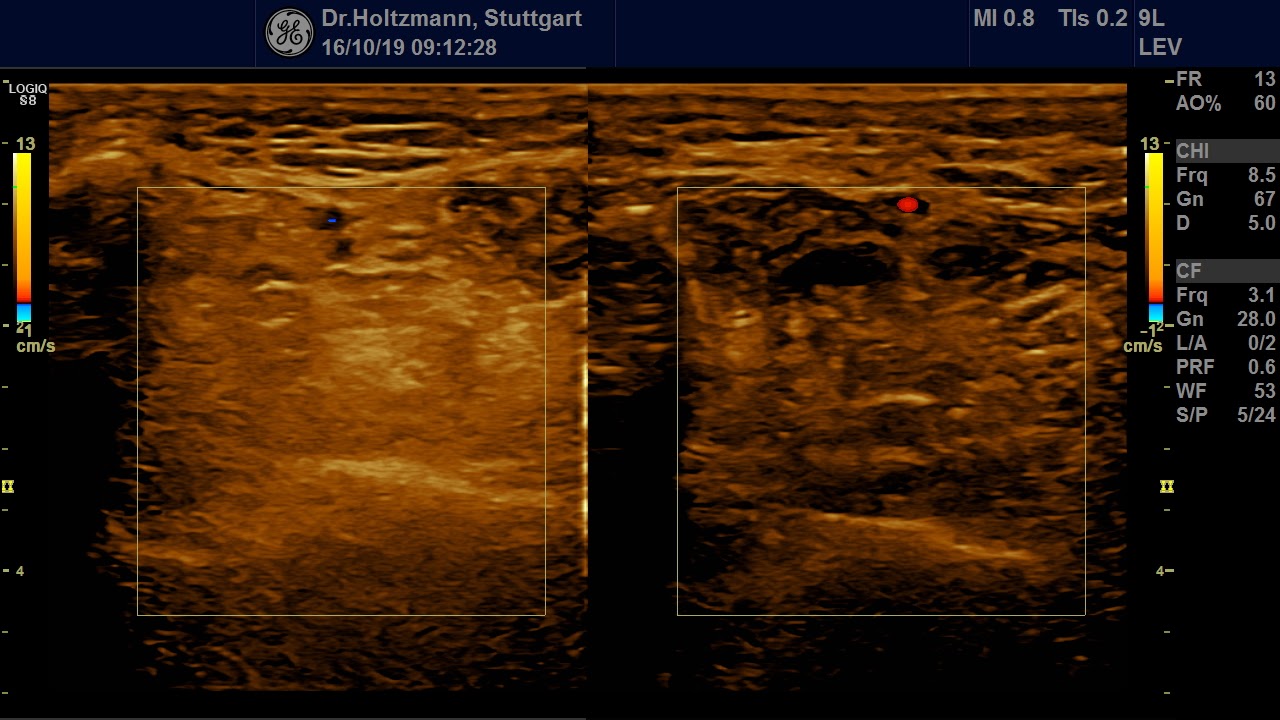
Abb. 6: Splitscreeneinstellung beim Faszienlogen-Scan bei positivem Palpationsbefund im linken Unterschenkel. Rechts ohne Palpationsbefund, die Echotextur ist normal. Im linken Transversalschnitt erkennt man verwaschene, unscharf begrenzte homogene mitteldichte Zonen. Erhöhte Impedanzunterschiede bzw. vermehrte Impedanzsprünge führen wie an einer körnigen, rauen Grenzfläche zu einer Artefakt ähnlichen Streuung. Es entsteht der Eindruck einer verwaschenen Echotextur.
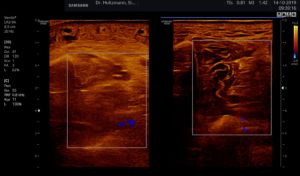
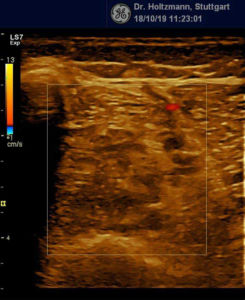
Abb. 7: Links: Subfasziales Ödem bei positivem Palpationsbefund. Sonografisch verwaschene, konfluierende Zonen mit angehobener Echogenität. Rechts: normale Echotextur.
Differenzialdiagnostisch sind die pathologischen Echogenitätsveränderungen bei neurogenen und myogenen Schädigungen zu beachten (3,5,12,15,20,21). Sie können bei identischen Echostrukturveränderungen ein Subfasziales Ödem suggerieren.
Um die Ausprägung des Subfaszialen Ödems standardisiert zu beurteilen, haben wir einen Score entwickelt (Tab. 1).
Er erleichtert das Therapie-Monitoring (mit nicht nachgiebigen Kompressionmedien) (8) sowie das diagnostische Screening auch im Hinblick auf eine definitive Thrombose Vorsorgeuntersuchung (Preventive checkup).
Tab. 1: Semiquantitativer Score zur sonografischen Graduierung des Subfaszialen Ödems
Ausprägung des Subfaszialen Ödems Grad 0
Normale, reflexarme, niedrige Echogenität der Logenmuskulatur (M. flexor digitorum longus, M. tibialis posterior, M. flexor hullucis longus). Reflexreiche, leuchtende Epimysien, Perimysien (Septen) und Gefäßbindegewebe in “dunkler” Echostruktur der Muskulatur, sog. “Sternenhimmelphänomen”.
Ausprägung des Subfaszialen Ödems Grad 0
Normale, reflexarme, niedrige Echogenität der Logenmuskulatur (M. flexor digitorum longus, M. tibialis posterior, M. flexor hullucis longus). Reflexreiche, leuchtende Epimysien, Perimysien (Septen) und Gefäßbindegewebe in “dunkler” Echostruktur der Muskulatur, sog. “Sternenhimmelphänomen”.
Diskussion
Unsere sonografische Diagnostik entkräftet die gängige Arbeitshypothese, dass durch chronische venöse Stauungszustände, einem Druckgefälle folgend, eine Filtration von intravasaler Flüssigkeit in den interstitiellen Raum die Ursache des Subfaszialen Ödems sei (13).
Das klassische Ödem wird definiert als Austritt von Flüssigkeit aus dem Gefäßsystem und deren Ansammlung im extravasalen, interstitiellen Raum. Diese Ödeme imponieren im Ultraschall durch freie Flüssigkeit in den Interzellularspalten wobei das B-Bild streifig echofrei und somit dunkler wird. Exemplarisch am praefaszialen bzw. suprafaszialen Ödem erkennbar.
Das Subfasziale Ödem ist demzufolge keine klassische ödematöse Schwellung, da sonografisch keine freie Flüssigkeit im extravasalen Raum nachweisbar ist. In unseren Untersuchungen zeigte sich keine Reduktion, sondern ein charakteristisches Ansteigen der Echogenität mit Aufhellung des B-Bildes.
Die von unseren phlebologischen Vorfahren ertastete und als Subfasziales Ödem benannte Schwellung muss also anderer Genese sein. Somit lagen wohl auch die oben zitierten frühen Pathologen (2,10,11,17,19) auf ihrer Suche nach histopathologischen Veränderungen, die das Subfasziale Ödem objektivieren sollten (4), gar nicht so falsch. Sie beschrieben keine Ödeme im Sinne einer extravasalen Flüssigkeitsansammlung, sondern unspezifische muskuläre Strukturveränderungen, die unseren sonografischen Echogenitätsveränderungen entsprechen könnten.
Die von uns beschriebenen Echostrukturveränderungen im Falle einer tastbaren und druckdolenten Schwellung der tiefen Flexorenloge lassen sich mit höchster Wahrscheinlichkeit auf eine biochemische Veränderung der extrazellulären Matrix als Reaktion auf die venöse Hypertension zurückführen. Dabei treten die Proteoglykane in der amorphen Grundsubstanz des ungeformten Bindegewebes in den Vordergrund. Von ihnen ist bekannt, dass sie mit einer Volumenzunahme (Quellung) und konsekutiv mit einer verstärkten Echogenität reagieren können.
Das ungeformte Bindegewebe besteht histologisch aus beweglichen und ortsansässigen Zellen, die in eine extrazelluläre Matrix eingebettet sind. Die extrazelluläre Matrix bildet gemeinsam mit den Zellen ein dreidimensionales Maschenwerk, dessen Zwischenräume durch besagte Proteoglykane ausgefüllt werden.
Proteoglykane sind sehr große Moleküle, welche zu 95 % aus Kohlenhydraten und zu 5 % aus Proteinen bestehen. Die chemischen Eigenschaften entsprechen aufgrund des hohen Kohlenhydratanteils denen der Polysaccharide. Die prosthetischen Gruppen der Proteoglykane sind sich wiederholende Disaccharideinheiten. Diese sind meist sulfatiert, was die stark negative Ladung und damit die hohe Wasserbindungskapazität bedingt. Mit ihrer hohen Wasserbindungskapazität erfüllen sie unter anderem eine raumfüllende Wirkung als Grundsubstanz der Extrazellulärmatrix im Knorpel, den Sehnen und zusätzlich als Gleitmittel in Gelenken (Chondroitinsulfat, Keratansulfat). Dabei sollen die stark quellenden Proteoglykane der Aufnahme und Verteilung von Kompressionskräften dienen.
Die stauungsreaktiv quellenden Proteoglykane in der extrazellulären Matrix verändern graduell die Echostruktur der tiefen Flexorenmuskulatur und verstärken im gequollenen Zustand die Schallreflexion. Erhöhte Impedanzunterschiede bzw. vermehrte Impedanzsprünge führen wie an einer körnigen, rauen Grenzfläche zu einer Streuung. Die Echotextur wirkt verwaschen (9) und kann sich je nach Intensität des Subfaszialen Ödems bis zum völligen Verlust der normalen Echotextur steigern.
Das sonografische Bild des Subfaszialen Ödems zeigt die gleiche Echogenitätssteigerung wie das myosonografische Bild des Muskelödems (15) und die gleichen sonografischen Merkmale (diffus erhöhte Echogenität) wie beim akuten und chronischen Kompartmentsyndrom (3,5,12,15).
Man kann verallgemeinern, dass mit zunehmendem intrakompartimentalem Druck die muskuläre Echointensität steigt (15).
Differenzialdiagnostisch sind die pathologischen Echogenitätsveränderungen bei neurogenen und myogenen Schädigungen zu beachten (3,5,12,15,20,21). Sie können bei identischen Echostrukturveränderungen ein Subfasziales Ödem suggerieren.
Nur sehr erfahrenen Palpationsdiagnostikern war es bisher möglich einen neurogenen, von der LWS ausgehenden Beschwerdekomplex mit muskulärer Schutzanspannung vom venösen Beschwerdebild bei subfaszialer Schwellung zu diskriminieren. Neben der ähnlichen Schmerzsymptomatik bieten beide einen positiven Palpationsbefund. Mit dem sonografischen Faszienlogen-Scan ist erstmals eine eindeutige Differenzierung leicht möglich. Die neurogenen Ursachen (LWS-Syndrom mit Reizung des N. tibialis) zeigen im akuten Stadium zunächst keine Echostrukturveränderung, die venöse Ursache (Subfasziales Ödem) Echogenitätsveränderungen °1-°4.
Alle Objektivierungsversuche des Subfaszialen Ödems, die nach den Bemühungen der zitierten frühen Pathologen vorgenommen wurden, scheiterten. Auch die Versuche auf radiologischem Gebiet (Haid-Fischer, 1970) (6).
2017 veröffentlichte Stumptner (18) eine Arbeit, in der das Subfasziale Ödem mit der Magnetresonanztomografie (MRT) objektiviert werden sollte. Bei seiner Darstellungstechnik sind alle Gewebeabschnitte des Unterschenkelquerschnittes von MRT-Signalveränderungen betroffen. Er geht davon aus, dass die venöse Hypertension der tiefen Venen zu einer subfaszialen gleichmäßigen Vermehrung des Wassergehalts im Unterschenkel der Patienten führt. Das originäre, palpable Subfasziale Ödem erstreckt sich allerdings nur auf das hintere tiefe Kompartment (6). In unserer sonografischen Diagnostikmethode sind die charakteristischen Echogenitätsveränderungen spezifisch auf diese zentrale Gefäß-Nerven-Straßen beschränkt. Auf den Ort, an dem auch mit der subtilen Palpationstechnik eine druckdolente Schwellung tastbar ist.
Aus diesem Grund sind wir skeptisch, ob die von Stumptner gezeigten MRT-Signalveränderungen das phlebologische Phänomen zeigen, das Subfasziales Ödem genannt wird.
Schlussfolgerung
Der sonografische Faszienlogen-Scan hat sich seit Februar 2019 in unserer Ambulanz als ein zuverlässiges, reproduzierbares, dokumentierbares Instrument zur Diagnostik und Monitoring des Subfaszialen Ödems bewährt. Diese Untersuchungsmethode stellt weder an den Untersucher noch an die Gerätetechnik hohe Anforderungen.
Da wir das Subfasziale Ödem als das zentrale Substrat der venösen Pathologie betrachten, ist der sonografische Faszienlogen-Scan unser phlebologisches First-Line-Screening und Therapie-Monitoring Instrument (mit nicht nachgiebigen Kompressionsverbänden (8)) geworden. Er stellt in letzter Konsequenz auch eine objektive Vorsorgeuntersuchung im Hinblick auf die Entstehung der Phlebothrombose dar.
Literatur
- Ackermann R. Sonographie traumatischer Veränderungen der Muskulatur. Braun B, Günther R, Schwerk WB (Hrsg.), Ultraschalldiagnostik. Lehrbuch und Atlas. Ecomed, Landsberg/Lech 1995;1-41.
- Brass K. Aufbau und Entstehung der Beinvenenthrombose. Frankfurt. Z. Path. 1941;56:74.
- Cartwright MS, Demar S, Griffin LP et al. Validity and reliability of nerve and muscle ultrasound. Muscle Nerve 2013;47:515–521.
- Fischer H. Eine neue Therapie der Phlebitis. Medizin Klinik 1910;30.
- Grimm A, Axer H, Quasthoff S. Methodik Muskelsonografie. In: Bischoff C, Buchner H, Hrsg. SOPs Neurophysiologische Diagnostik. Georg Thieme Verlag Stuttgart, 2018. doi:10.1055/b-005-149022.
- Haid-Fischer F, Haid H. Venenerkrankungen. Phlebologie für Klinik und Praxis. Georg Thieme Verlag, Stuttgart 1985.
- Harland U. Die Abhängigkeit der Echogenität vom Anschallwinkel an Muskulatur und Sehnengewebe. Z Orthop, 1988;126:117-124
- Holtzmann M, Leben K. Spezifischer biphasischer Druckaufbau unter nicht nachgiebigen Kompressionsverbänden beim intensiven Gehen. Vasomed 2020;2:54-60.
- Lutz HTH. Ultraschallfibel Innere Medizin. Springer Verlag Berlin, Heidelberg, 2007;122
- Neumann R. Ursprungszentren und Entwicklungsformen der Beinvenenthrombose. Virchows Arch. Path. Anat. 1938;301:708
- Olow R. zit. nach Rössle 1937. In Haid-Fischer F, Haid H. Venenerkrankungen. Phlebologie für Klinik und Praxis. Georg Thieme Verlag, Stuttgart 1985;59-60.
- Pillen S, Arts IM, Zwarts MJ. Muscle ultrasound in neuromuscular disorders. Muscle Nerve 2008;37:679–693
- Pschyrembel – Klinisches Wörterbuch. De Gruyter, Berlin 1998;1143
- Rabe E, Gerlach HE. Praktische Phlebologie. Georg Thieme Verlag, Stuttgart 2000;86
- Reimers CD, Gaulrapp H, Kele H (Hrsg.). Sonographie der Muskeln, Sehnen und Nerven. Untersuchungstechnik und Befundinterpretation. Deutscher Ärzte-Verlag, Köln 2004.
- Roberts CS et al. Diagnostic ultrasonography: applications in orthopedic surgery. Clin Orthop. 2002;401:248-264
- Rössle R. Über die Bedeutung und Entstehung der Waden-Venenthrombosen. Virchows Arch. path. Anat. 1937;300:180
- Stumptner T. Das subfasziale venöse Ödem im NMR. Phlebologie 2018;47: 205-209
- Voegt H. Veränderungen der Wadenmuskulatur bei Venenthrombose und langem Krankenlager. Virchows Arch. path. Anat. 1937;300:190
- Walker FO, Cartwright MS. Neuromuscular Ultrasound. Philadelphia: Elsevier Saunders; 2011
- Zaidman CM, van Alfen N. Ultrasound in the Assessment of Myopathic Disorders. J Clin Neurophysiol 2016;33:103-111.